Bonjour,
Phagothérapie: des virus pour lutter contre la résistance aux antibiotiques?
Ils sont nanoscopiques, omniprésents dans nos écosystèmes et, avec leur grande «tête», ils ressemblent un peu à des modules lunaires. Eux, ce sont les phages ou bactériophages et, malgré leur petite taille, ils pourraient bien représenter une partie de la solution à l’une des plus grandes menaces sanitaires du siècle: la résistance aux antibiotiques, responsable en 2019 de la mort de quelque 1,2 million de personnes.

Anna Bonvin
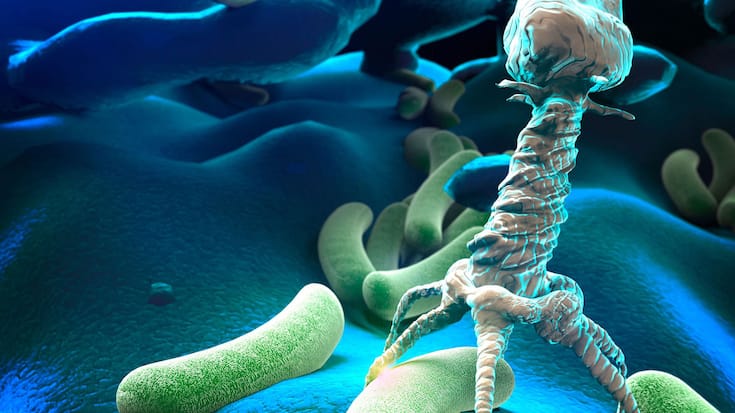
Vue au microscope électronique d’un bactériophage. Ces virus sont naturellement programmés pour infecter les bactéries.
Giovanni Cancemi/ShutterstockLes phages sont des virus «tueurs» de bactéries tout en étant inoffensifs pour l’homme. Leur utilisation thérapeutique pour lutter contre les infections bactériennes n’est pas nouvelle. Découverte au début du siècle passé, leur utilisation en médecine, appelée phagothérapie, a rencontré un vif succès avant que l’avènement des antibiotiques ne la fasse tomber en désuétude. Toujours pratiquée dans de rares pays comme la Géorgie, la Pologne ou la Russie, elle connaît aujourd’hui un regain d’intérêt dans les pays occidentaux, notamment en Suisse.
La phagothérapie, un traitement ultra-spécifique
La phagothérapie est une méthode de lutte contre les infections s’appuyant sur l’écosystème formé par les bactéries et leurs prédateurs naturels, les virus bactériophages (nommés aussi phages). Sur le papier, elle semble présenter de nombreux avantages. Les phages sont en effet les organismes les plus répandus sur Terre, ce qui fait d’eux une ressource naturelle disponible en abondance. De plus, comme ces virus s’attaquent uniquement aux bactéries pathogènes, leur utilisation dans un cadre thérapeutique ne devrait en principe pas engendrer d’effets secondaires.
Mais ce qui différencie véritablement les phages des autres médicaments, c’est leur champ d’action ultra-spécifique: la majorité d’entre eux agit en effet contre une seule bactérie, voire une seule souche bactérienne. «Au contraire de l’antibiothérapie, la phagothérapie ne sera pas efficace contre un large éventail d’agents infectieux, explique le Dr Diego Andrey, médecin chef de clinique au Service des maladies infectieuses des Hôpitaux universitaires de Genève (HUG) et chef de clinique scientifique au département de médecine de l’Université de Genève (Unige). En revanche, elle permet d’agir de façon extrêmement ciblée, notamment contre les bactéries ayant développé des résistances aux antibiotiques.»
>> Lire aussi: «Les gens ne veulent plus d’une médecine paternaliste»
La phagothérapie est une méthode de lutte contre les infections s’appuyant sur l’écosystème formé par les bactéries et leurs prédateurs naturels, les virus bactériophages.
Shutterstock
La phagothérapie est une méthode de lutte contre les infections s’appuyant sur l’écosystème formé par les bactéries et leurs prédateurs naturels, les virus bactériophages.
ShutterstockUne nouvelle réjouissante, sachant que ces bactéries antibiorésistantes sont chaque jour plus nombreuses et que les solutions thérapeutiques actuelles ne parviennent plus à traiter un nombre croissant d’infections. La phagothérapie apparaît donc comme une potentielle solution, à condition de pouvoir identifier le bactériophage associé à la bactérie concernée. «En théorie, il existe des phages pour chaque espèce bactérienne, déclare le Dr Andrey. La recherche a déjà mis en évidence de nombreux phages actifs contre les principales bactéries résistantes aux antibiotiques, notamment le staphylocoque doré ou le Pseudomonas. Mais il y en a beaucoup d’autres à découvrir.»
Et en Suisse?
L’intérêt de ces virus tueurs de bactéries n’est pas passé inaperçu en Suisse, où divers projets liés aux phages ont récemment vu le jour. Le Centre hospitalier universitaire vaudois (CHUV) à Lausanne a ainsi défini la phagothérapie comme une des «nouvelles priorités» de son plan stratégique 2019-2023 et a mis sur pied le laboratoire des bactériophages et de phagothérapie. «Notre cible principale est le Pseudomonas aeruginosa, une bactérie résistante aux antibiotiques causant de graves complications respiratoires chez les patients atteints de mucoviscidose, explique le Dr Grégory Resch, responsable de ce laboratoire et chercheur en microbiologie au CHUV. Nous avons assemblé depuis 2010 une très large collection de phages actifs contre cette bactérie, mais pour l’instant nous n’avions pas dépassé le stade de la recherche. Cela devrait toutefois bientôt changer, car une équipe multidisciplinaire est en train de mettre sur pied une étude clinique de phagothérapie pour les patients atteints d’infections résistantes aux antibiotiques.»
>> Lire aussi: Pourquoi certains Suisses vont-ils peu chez le médecin?
A Genève aussi, la phagothérapie est vue comme une piste prometteuse pour lutter contre certaines infections. Aux HUG, un petit nombre de patients atteints d’infections particulièrement compliquées ont même déjà pu bénéficier d’un traitement par bactériophages. «Ces patients ont montré une amélioration ou une guérison de l’infection, commente le Dr Diego Andrey. Les effets de ces traitements par phages sont donc encourageants, mais ils ne sauraient être uniquement attribués aux phages, car ces derniers ont été administrés comme compléments aux antibiotiques déjà prescrits et autres traitements nécessaires.»
Une méthode peu documentée
La phagothérapie paraît certes pleine de promesses, mais elle peine à se développer dans notre pays. En cause, l’absence de données sur le sujet, la méthode n’ayant jamais fait l’objet d’études conformes aux critères de recherche occidentaux. «La phagothérapie semble efficace et sans risque sur le papier, mais beaucoup reste encore à prouver, observe le Dr Andrey. Ce que nous savons de son application pratique provient principalement de nos collègues de Géorgie, qui cumulent 90 ans d’expérience dans le domaine. Malheureusement, cette expertise est très peu documentée, par manque de publications médicales. Par exemple, l’absence théorique d’effets secondaires liés aux phages est bel et bien attestée par l’expérience de nos confrères géorgiens, mais peu de données scientifiques l’ont confirmée.» Cette méthode comporte donc de nombreuses zones d’ombre, qui demandent à être éclaircies avant de pouvoir envisager une utilisation clinique. Des études sont toutefois en cours, notamment aux Etats-Unis, en France ainsi que prochainement en Suisse, et devraient bientôt apporter des réponses.
Les phages, un traitement de dernier recours
Il faudra donc patienter avant de pouvoir se faire prescrire des phages thérapeutiques, ce qui suppose d’abord qu’ils soient autorisés par Swissmedic, l’autorité nationale de surveillance des médicaments. Les médecins peuvent toutefois déjà les utiliser de façon ponctuelle chez des malades en impasse thérapeutique, c’est-à-dire pour qui tous les traitements autorisés se sont révélés inefficaces. «Si la phagothérapie a été utilisée aux HUG, c’est parce que nous étions confrontés à des infections particulièrement résistantes ou difficiles à traiter, contre lesquelles tous les traitements disponibles avaient échoué, explique le Dr Diego Andrey. Nous avons alors eu recours aux phages, mais seulement après avoir longuement pesé les risques et les bénéfices de ce traitement pour le patient.» De plus, les phages n’ont jamais été administrés seuls, mais systématiquement associés à des antibiotiques. «Il ne s’agit pas d’un projet de recherche, poursuit le Dr Andrey. L’important est la sécurité du patient, nous ne prenons donc pas le risque d’administrer les phages seuls.»
>> Lire aussi: La solitude favoriserait le diabète
Une arme de plus pour combattre les bactéries
Le monde de la recherche n’est pas le seul à s’intéresser aux virus mangeurs de bactéries et les médecins observent une augmentation croissante de patients souhaitant bénéficier de la phagothérapie. «Cet afflux de demandes nous a fait ouvrir les yeux sur la réalité concrète de la phagothérapie, commente le Dr Andrey. Nous savons que certains patients se rendent en Géorgie pour se faire traiter avec des phages, mais cette méthode est aussi en train d’arriver chez nous.» Point important: il semble que les phages ne soient pas destinés à remplacer les antibiotiques, du moins pas dans un futur proche. «Je pense que les phages vont être utilisés de plus en plus fréquemment, estime le Dr Andrey. Mais ils ne vont pas remplacer les antibiotiques. Il s’agit plutôt d’une arme en plus dans notre arsenal pour combattre les infections, notamment celles causées par les bactéries résistantes.» Un avis partagé par la majorité de la communauté scientifique et corroboré par un nombre croissant d’études de cas faisant état d’un réel bénéfice thérapeutique lorsque les phages sont ajoutés à un traitement par antibiotiques.
Contenu externe
Vous trouverez ici un contenu externe complémentaire. Si vous acceptez que des cookies soient installés par des fournisseurs externes et que des données personnelles soient ainsi transmises à ces derniers, vous pouvez autoriser tous les cookies et afficher directement le contenu externe.
Le cas Patterson, ou comment l’amour contribua à la redécouverte de la phagothérapie
La phagothérapie est inventée en 1915 par le biologiste français Félix d’Hérelle qui, le premier, découvre l’existence des écosystèmes formés par les phages et les bactéries. Cette méthode est ensuite utilisée dans le monde entier, avant que les pays occidentaux ne la délaissent au profit des antibiotiques. Si de rares pays de l’ancienne Union soviétique ont continué à la pratiquer, la phagothérapie tombe pour ainsi dire dans l’oubli, avant d’être remise sur le devant de la scène il y a quelques années par le «cas Patterson».
Fin 2015, l’universitaire américain Tom Patterson est infecté par l’agent pathogène Acinetobacter baumannii lors de vacances en Egypte avec son épouse, l’épidémiologiste Steffanie Strathdee. Cette bactérie est connue pour sa résistance aux antibiotiques et, rapidement, l’infection gagne du terrain sans qu’aucun traitement puisse l’enrayer. Steffanie Strathdee assiste, impuissante, à la dégradation de l’état de santé de son époux, qui finit par tomber dans le coma. Elle entend alors parler des phages, ces virus mangeurs de bactéries, et entreprend une folle croisade auprès du service gouvernemental responsable de la pharmacovigilance aux Etats-Unis, la Food and Drug Administration (FDA), pour que son époux puisse bénéficier d’un traitement par phagothérapie. En 2016, la FDA accorde cette autorisation en urgence et Tom Patterson reçoit une injection de phages thérapeutiques. Et là, c’est le miracle: en à peine quelques semaines, Patterson guérit totalement.
Contenu externe
Vous trouverez ici un contenu externe complémentaire. Si vous acceptez que des cookies soient installés par des fournisseurs externes et que des données personnelles soient ainsi transmises à ces derniers, vous pouvez autoriser tous les cookies et afficher directement le contenu externe.
Depuis, Steffanie Strathdee a ouvert un centre de recherche en phagothérapie à San Diego (USA), le Center for Innovative Phage Applications and Therapeutics (IPATH). Mais surtout, son incroyable ténacité aura permis de remettre en lumière le potentiel thérapeutique des bactériophages dans le contexte de la résistance aux antibiotiques.
Le défi de la production de phages: Comment créer ce traitement sur mesure?
Les pays occidentaux semblent se diriger vers une approche personnalisée de la phagothérapie, où chaque phage est soigneusement sélectionné en fonction de la bactérie à cibler. Mais comment parvient-on à créer ce traitement sur mesure? Tout d’abord, la bactérie ayant infecté le patient est envoyée dans un laboratoire possédant une banque de phages. Là, les chercheurs testent leur collection de virus jusqu’à identifier le phage actif contre la bactérie en question. Ce phage est ensuite multiplié et purifié afin d’éliminer les contaminants bactériens résiduels. Après plusieurs contrôles, le produit final est envoyé aux cliniciens pour être administré au patient.
>> Lire aussi: Sclérose en plaques: du côté de la médecine
Même si ce procédé semble complexe, le CHUV a décidé de relever le défi, comme l’explique Grégory Resch, responsable du laboratoire des bactériophages et de phagothérapie et chercheur en microbiologie: «Standardiser un processus de production des phages représente un véritable challenge. En effet, chacun de ces virus est différent et possède donc des spécificités propres, également en matière de production. Nous nous efforçons toutefois d’uniformiser ce processus au maximum.»
Le but de l’équipe du CHUV? Obtenir une autorisation de production de phages officielle de la part des autorités, ce qui en ferait le premier centre académique européen produisant des phages conformément aux normes des bonnes pratiques de fabrication (BPF) en vigueur. Cette autorisation représenterait une avancée considérable: elle permettrait notamment de ne plus dépendre des rares laboratoires étrangers spécialisés dans la production de phages et qui peinent déjà à satisfaire les demandes affluant du monde entier. Reste à savoir si les phages produits à Lausanne apporteront un réel bénéfice aux patients dans la lutte contre les bactéries. Affaire à suivre, donc…